随着具有潜在疗效的生物分子数量不断增加,对了解这些生物分子结构复杂性和稳定性的需求也在与日俱增。相对于其它干燥技术,冷冻干燥依然是很受欢迎的稳定的技术,原因很简单:它是一个低温的过程,可以用于处理生物溶液而使其免遭破坏,提高药物制剂的稳定性和货架期。然而,冷冻干燥又是一个复杂的过程,如果设计不当,容易在处理过程与储存过程中产生不稳定性。
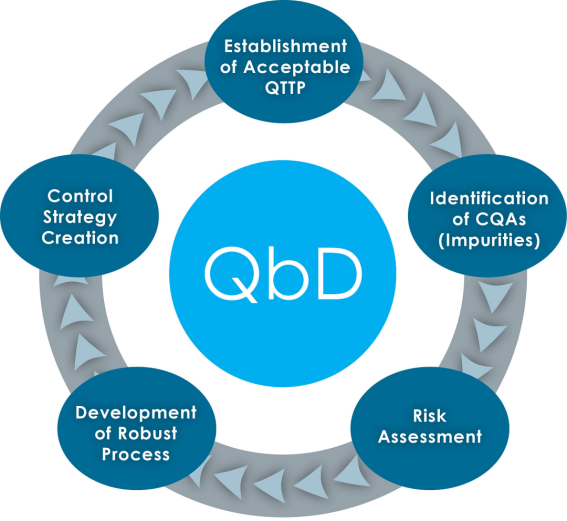
图1:QbD质量源于设计理念
基于PAT ICH Q8/Q9/Q10准则对QbD的规范法案中可以看出,产品与过程的性能特征都需要经过科学设计以满足特定目标,而不是凭经验从实验中推导。
一、为什么要遵循QbD进行冷冻干燥?
法规要求
ICH指南Q8、Q9、Q10要求。FDA及GMP近年来也强烈建议遵循QbD理念,以最大程度上保证产品质量,减少和控制风险。
美国FDA在2004年"Pharmaceutical cGMP for 21st-A Risk Based Approach" 报告中正式提出了QbD的概念,并且被人用药品注册规定国际协调会议(ICH)纳入质量体系当中。在ICH质量体系框图中,明确提出了要求达到理想的质量控制状态,必须从药物研发以及质量源于设计、质量风险管理以及药物质量体系三方面入手,即Q8,Q9和Q10 的结合;其中Q8 中明确说明质量不是通过检验注入到产品中,而是通过设计赋予的。
产品注册
- FDA/EMEA/MHRA认为基于实证或经验的方法不再足够好;
- 可重复性与稳健性不一样;
- 你需要知道边界值在哪里,你离失败的边缘有多近。
生产效益
用科学的原理来支撑你的冻干工艺,从而得到好的工艺和产品。
经济效益
您可以将生产经济融入到你的工艺设计,提高生产放大和技术转移的信心和工艺稳健性。
二、QbD相关术语——冻干过程关键参数
|
相关术语
|
关键质量属性(CQAs) |
|
目标产品质量概况((Q)TPP) |
|
|
关键工艺参数(CPPs) |
|
|
设计空间 ( DS ) |
|
|
可接受空间( AS ) |
|
|
操作空间( OS ) |
这就需要基于目标产品的情况(Q)TPP和CQAs得出CPPs,得到对目标过程的定义,再结合相关技术去建立设计空间和控制整个过程,按照既定的目标设计出合格的产品。
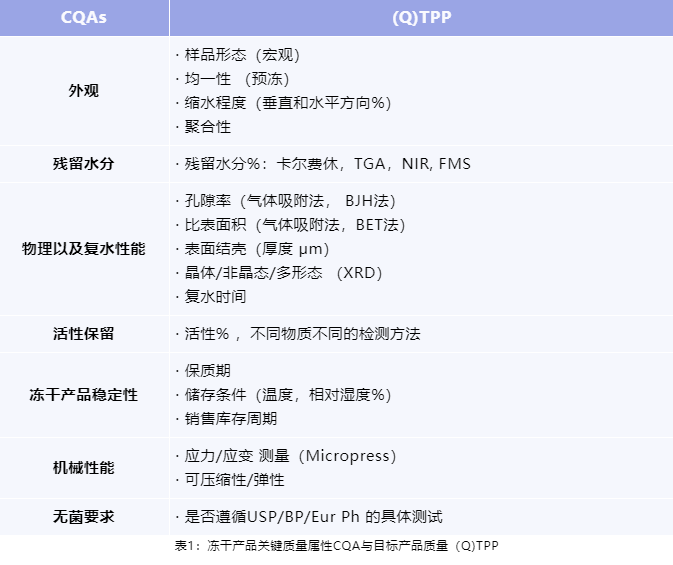
示例:冻干产品关键质量属性与目标产品质量
>冻干关键工艺参数(CPPs)
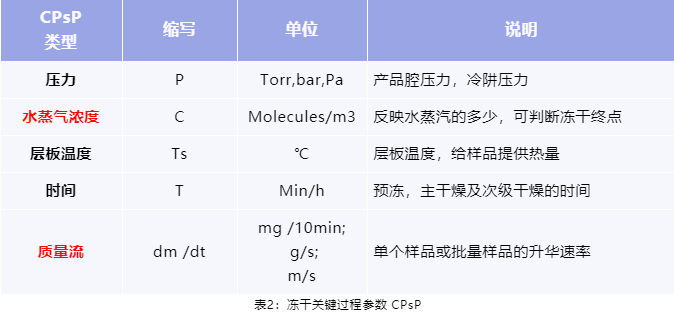
关键过程参数 CPsP(表2)
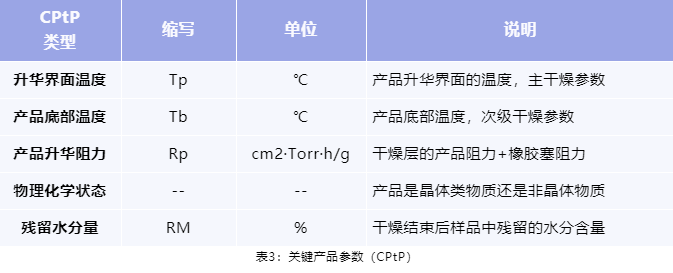
关键产品参数 CPtP(表3)
其他
● 小瓶/容器尺寸、传热系数(Kv);
● 灌装深度、浓度;
● 辐射热 / 冷却。
>冻干关键工艺参数与产品质量的关系:

三、如何遵循QbD进行冻干工艺设计,在冻干过程中降低风险?
>设备:深入了解你的冷冻干燥机
|
- 仔细阅读制造商的规格 |
|
- IQ / OQ测试–确认机器是否合格 |
|
- 阻塞流研究,了解设备的极限性能(最大升华速率)(图2) |
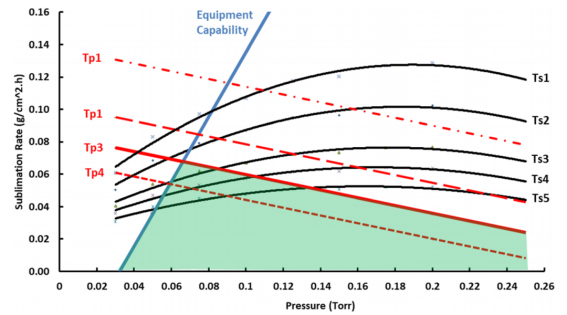
图2:设备能力曲线(蓝色)
|
设备极限性能测试方法: (1) 最小可控压力法; (2) 气流受阻点方法; (两种方法比较见图3) |
|
设备极限性能测试技术: LyoFlux(TDLAS)/MTM |

图3:最小可控压力法和气流受阻点方法比较
>配方:理解配方关键温度
*冷冻干燥显微镜
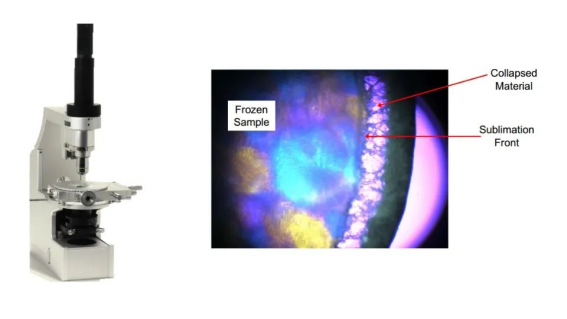
图4:冻干显微镜及塌陷温度测定
- 定义配方塌陷温度和共晶点/共熔点;
- 微塌陷? 退火的影响?表面结壳?
*差示热分析/阻抗
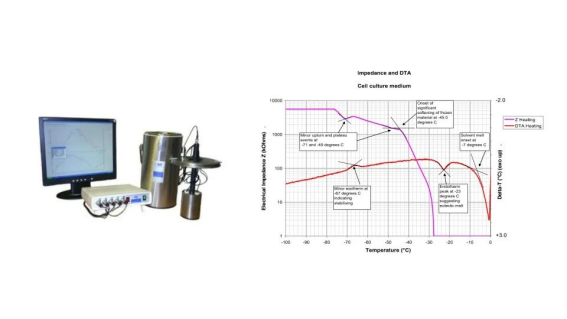
图5:差示热分析/阻抗
DTA或DSC:
测定显著的吸热和放热事件,如:结晶,熔化,玻璃化转变,吸热松弛等。
阻抗分析:
热技术可能无法发现分子迁移率的变化,阻抗分析能在更复杂的非晶态产品中提供玻璃化化过渡等事件。
>工艺动态
了解不断变化的平衡过程中的风险,用完善且先进的PAT工具,对冻干过程中所有的关键工艺参数(关键过程参数CPsP和关键产品参数CPtP进行实时在线的监测和控制),建立设计空间,确定边界值及合理且优化的工艺空间。
理解变化的风险(图6)
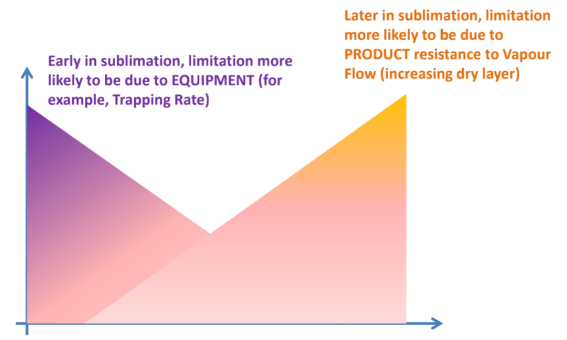
图6:一次干燥
关键工艺参数实时在线监测与控制,深入理解冻干过程(图7)
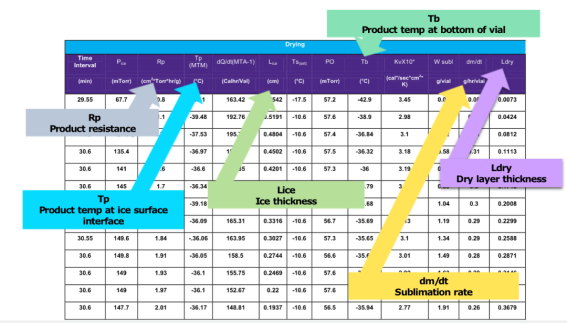
图7:冻干过程关键工艺参数实时在线监测与控制
冻干工艺设计空间DS(图8)
建立冻干工艺设计空间DS,确定边界值、可接受空间、操作和优化空间。
详细步骤如下:
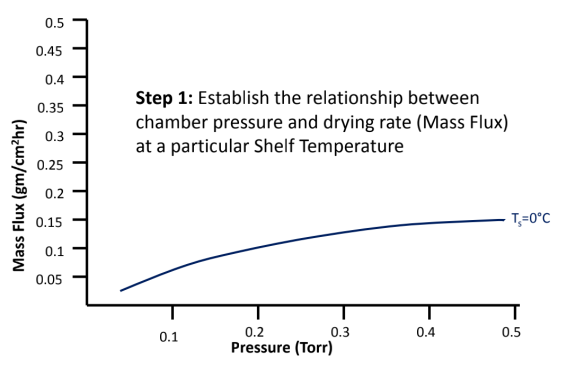
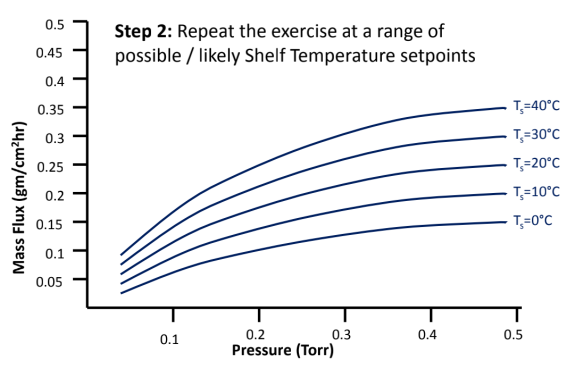
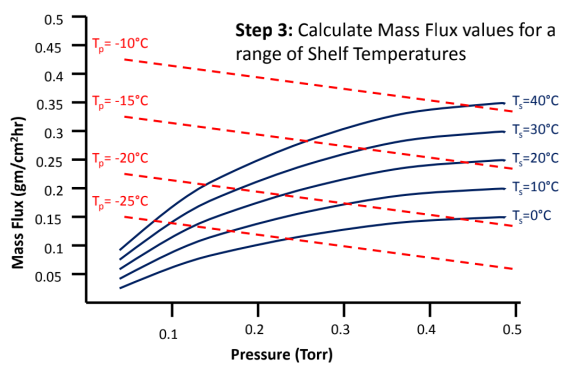
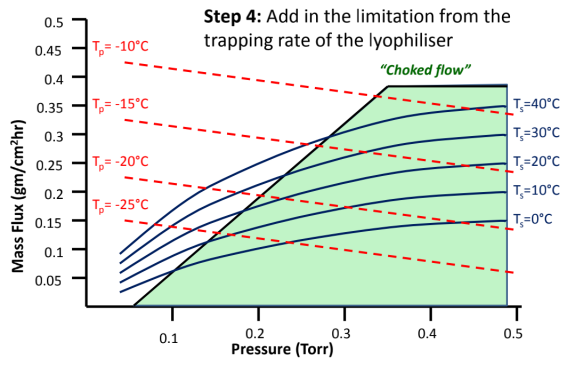
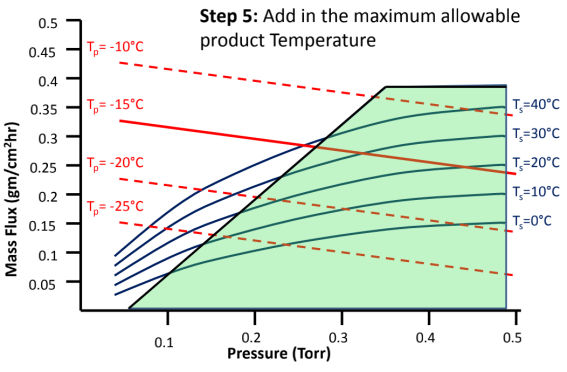
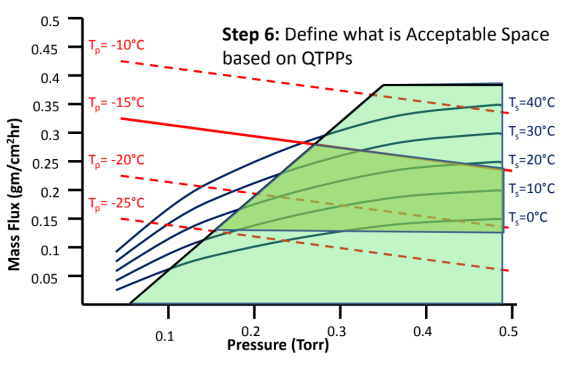
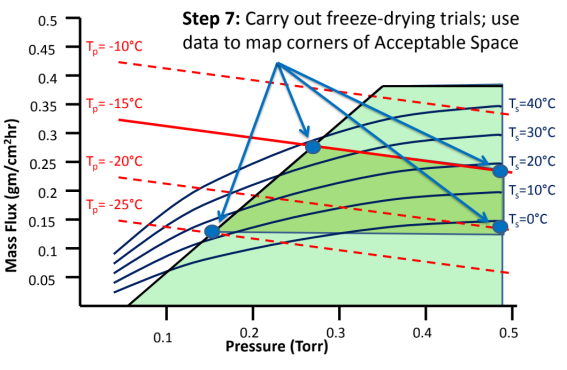
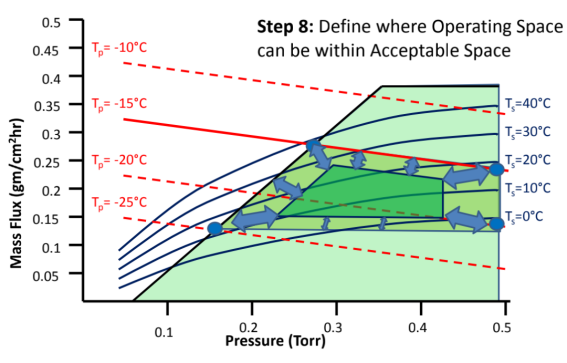
图8:如何建立冻干工艺设计空间
>基于QbD理念的冻干工艺设计整体流程
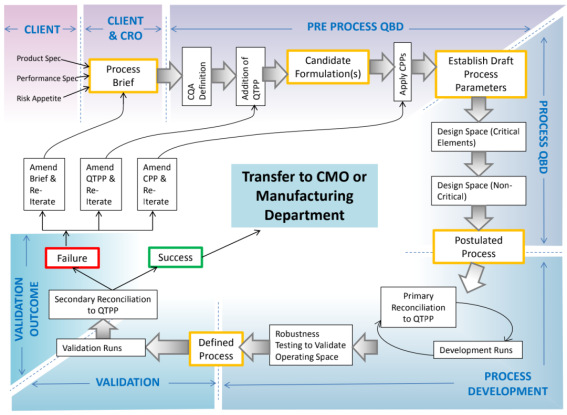
图9:基于QbD理念的冻干工艺设计整体流程图
总结
● QbD以预先设定的目标产品质量特性作为研发起点,在了解关键物质属性的基础上,通过试验设计,研究产品的关键质量属性,确立关键工艺参数。在多影响因素下,建立能满足产品性能且工艺稳健的设计空间(Design Space)。并根据设计空间,建立质量风险管理,确立质量控制策略和药品质量体系;
● 实施QbD是将PAT过程分析技术与风险管理综合应用于药品工艺开发的过程,它的目的不是消灭生产过程中的偏差,而是建立一种可以在一定范围内调节偏差来保证产品质量稳定性的生产工艺;
● QbD是cGMP的基本组成部分,是科学的,基于风险的全面主动的药物开发方法,从产品概念到工业化均精心设计,是对产品属性、生产工艺与产品性能之间关系的透彻理解;
● 基于QbD理念进行冻干工艺设计和优化,用CQA/QTPP/CPP来识别关键和非关键阶段以及每个阶段的相对风险。用“约束理论”识别最大风险点(主干燥),提供最大风险的解决方案,并将其它风险一起控制。对冻干配方、设备和工艺进行深入的理解和控制,最终按照即定的工艺目标设计并生产出合格且优质的产品,降低风险。这就是QbD所追求的!










